痛风(Gout)炎症“双煞”:TNF-α × IL-1β互作机制全解析
一、前言介绍
痛风急性发作(acute gout flare)常在24h内让关节肿成“馒头”,给患者带来巨大的痛苦。正是因为尿酸结晶——高尿酸血症导致单钠尿酸结晶(MSU crystals)在关节、滑囊、软组织沉积[1]:细胞应激、损伤,触发剧烈炎症反应。关节腔内快速积液,压迫局部神经,导致剧烈疼痛。急性痛风的炎症反应过程,会有多种炎症介质释放,互相促进和放大。尤其是细胞因子IL-1β 和TNF-α。
既往大家把聚光灯打在IL-1β上,却忽视了一位“老搭档”——TNF-α。近5年高通量蛋白组+单细胞测序陆续证实:TNF-α不仅“点火”,更是IL-1β持续外释的“放大器”。两者如何串扰?临床能否双靶点拦截?本文用最新文献为你拆解。
二、机制速览:从MSU晶体到“TNF-α➜IL-1β”正反馈
①启动信号
单钠尿酸盐(MSU)晶体被巨噬细胞吞噬→TLR4/NF-κB通路瞬间激活→pro-IL-1β、TNF-α转录双双上调[2]。
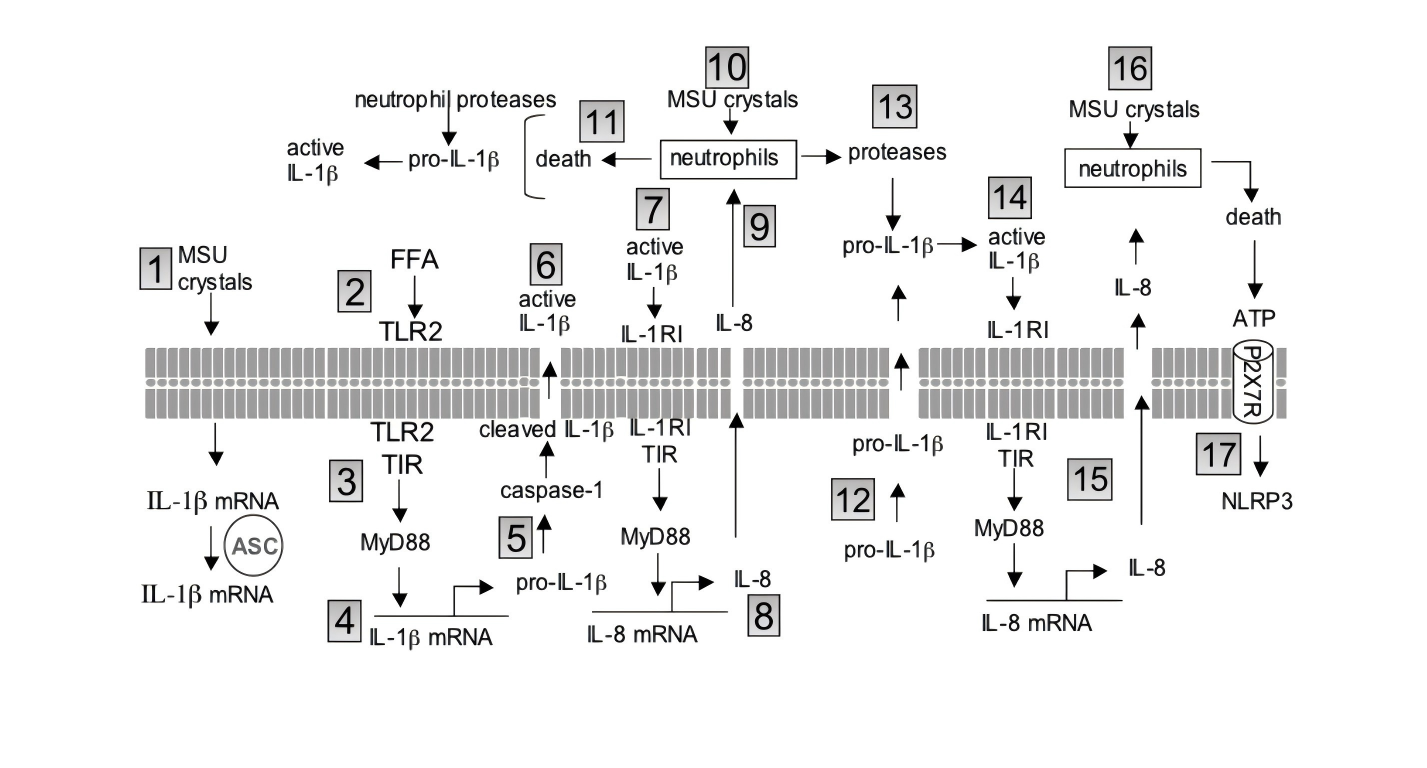
②翻译+释放
仅靠MSU不足以完成IL-1β蛋白翻译,需要“第二信号”。TNF-α恰能充当这一角色:诱导中性粒细胞表达pro-IL-1β mRNA;激活NLRP3-ASC-caspase-1平台,剪切并释放成熟IL-1β[1]。
③正反馈放大
IL-1β与IL-1R1结合→MyD88→NF-κB再次入核→TNF-α再度升高;同时刺激内皮细胞分泌IL-8,招募更多中性粒细胞,形成“细胞因子风暴”环路[1]。
三、数据说话:2021-2025关键发现
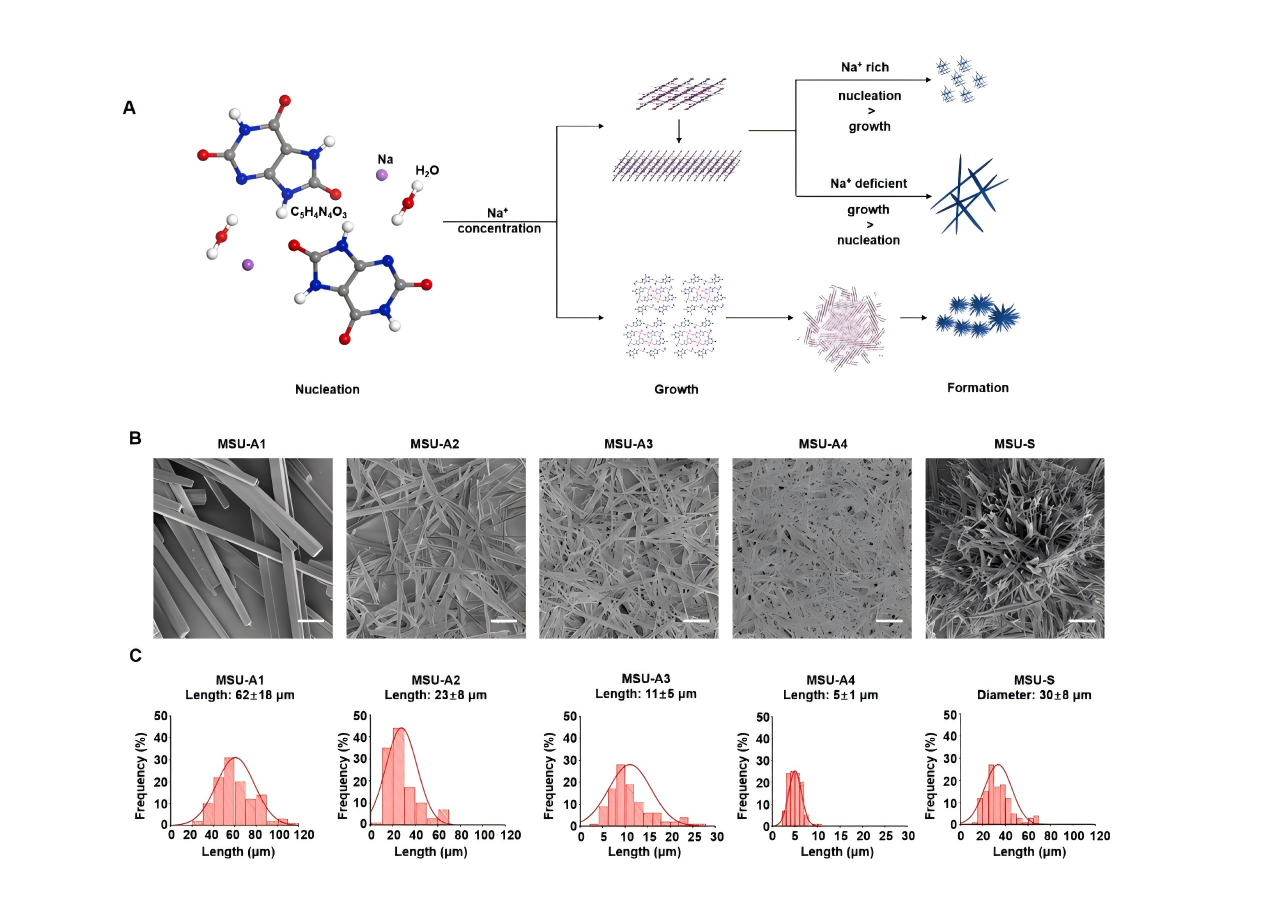
Chen等系统揭示了NLRP3炎症小体和线粒体ROS是MSU诱导炎症的关键,MSU晶体的理化性质在急性痛风炎症中又发挥着重要作用,明确了中等尺寸、长径比大的针状晶体最具致炎性,并提出了基于胆固醇清除和抗氧化的两种潜在治疗策略,为痛风干预提供了新思路[3]。
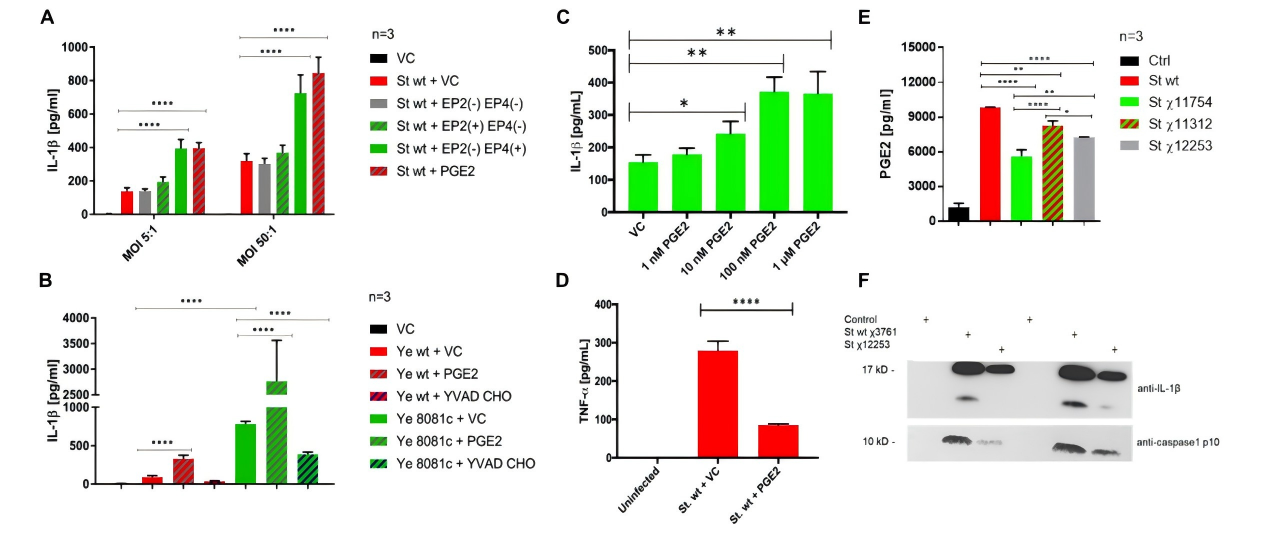
Sheppe等证明了PGE₂通过 EP4 受体激活炎症小体,可形成正反馈环路:炎症 → PGE₂ → IL-1β → 更多炎症[4],为开发基于免疫调控的抗感染策略提供了理论依据。
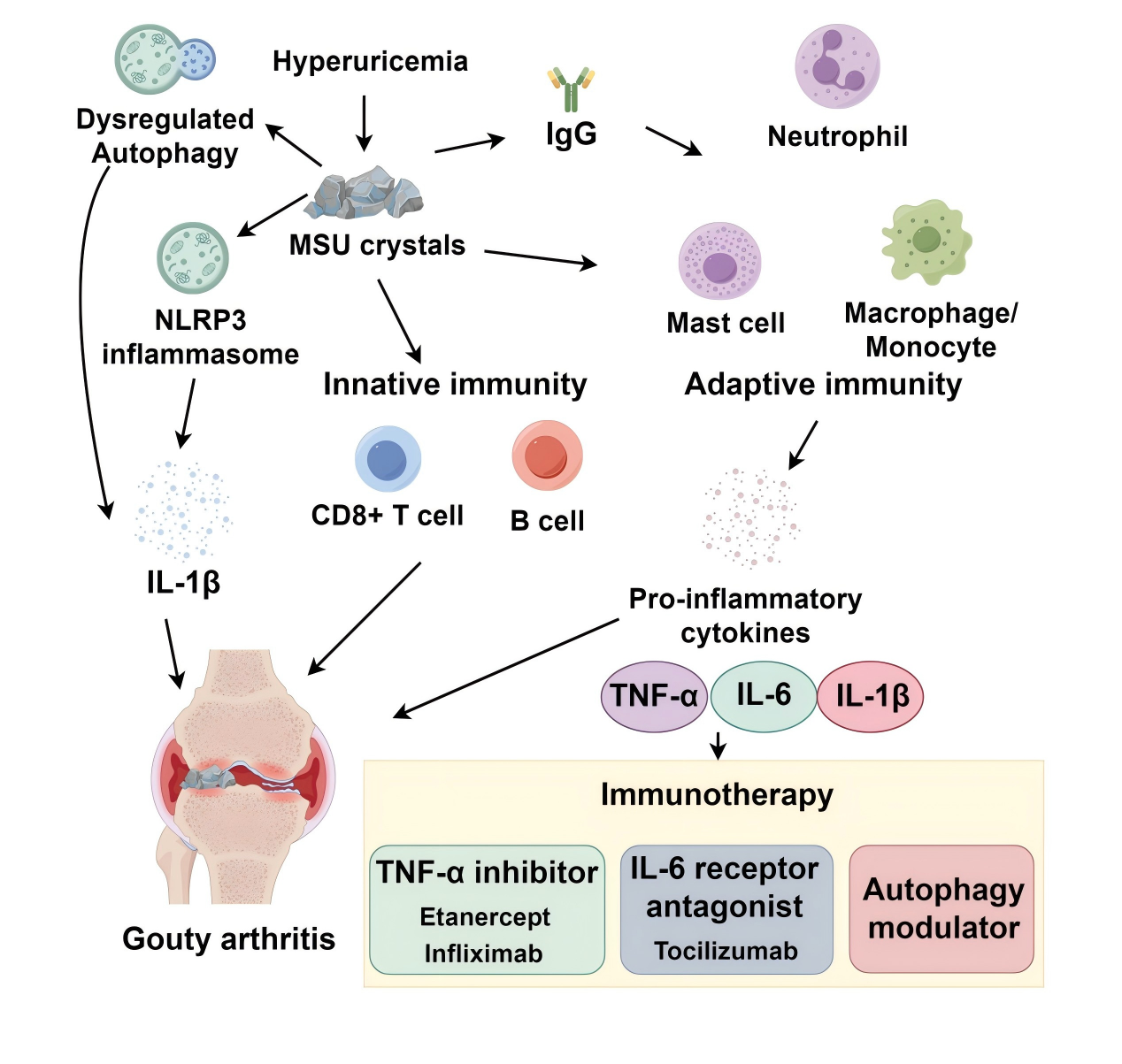
Chen等从系统免疫学视角出发,探讨了痛风性关节炎(Gouty Arthritis, GA)的发病机制,并重点分析了免疫反应在其中的作用机制,以及精准靶向治疗策略的最新进展。表明传统药物(如秋水仙碱、NSAIDs)疗效有限,生物制剂(如TNF-α抑制剂、IL-6拮抗剂)为难治性GA提供新选择,自噬调节、微生物组干预、表观遗传调控是未来精准治疗的重要方向[5]。
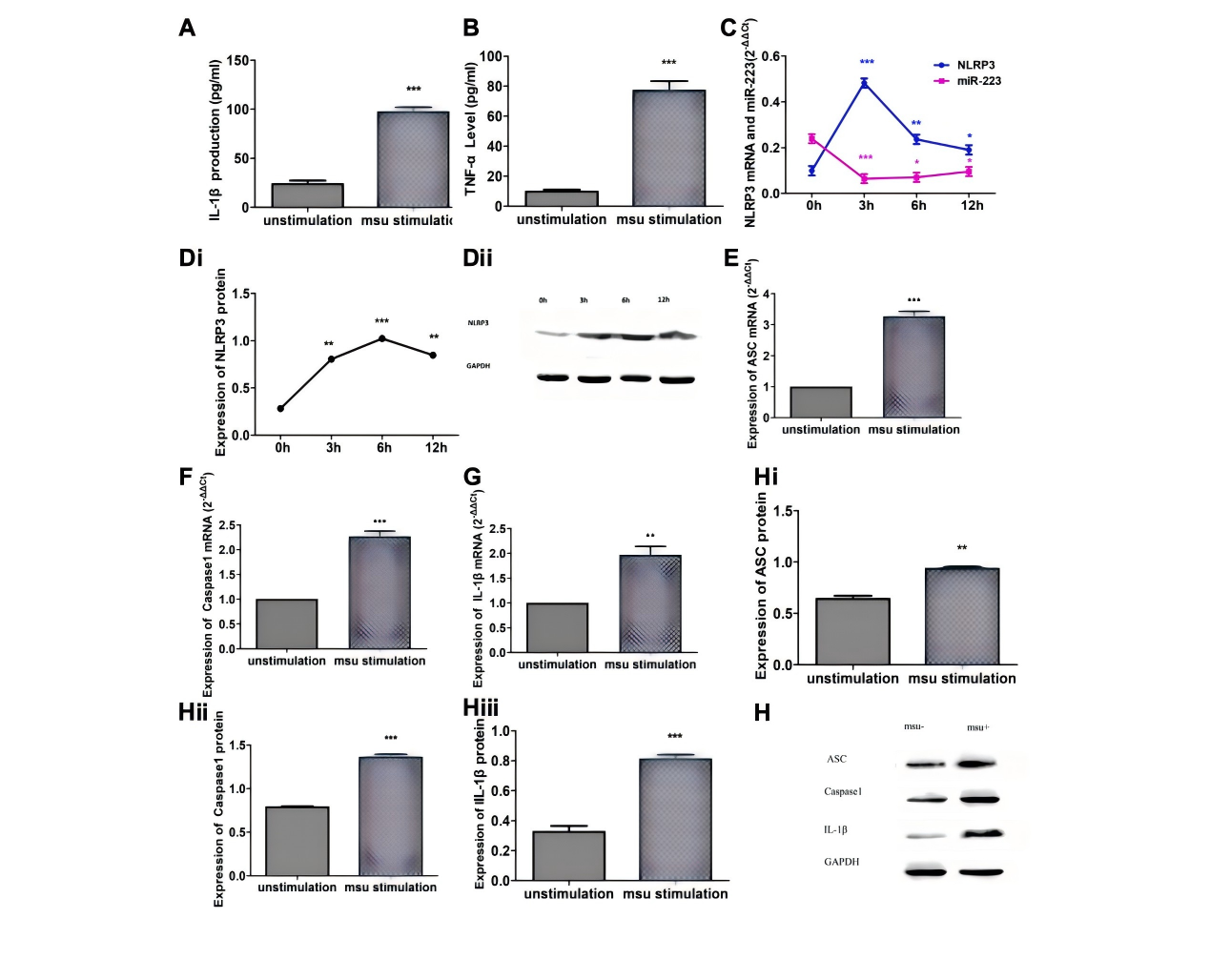
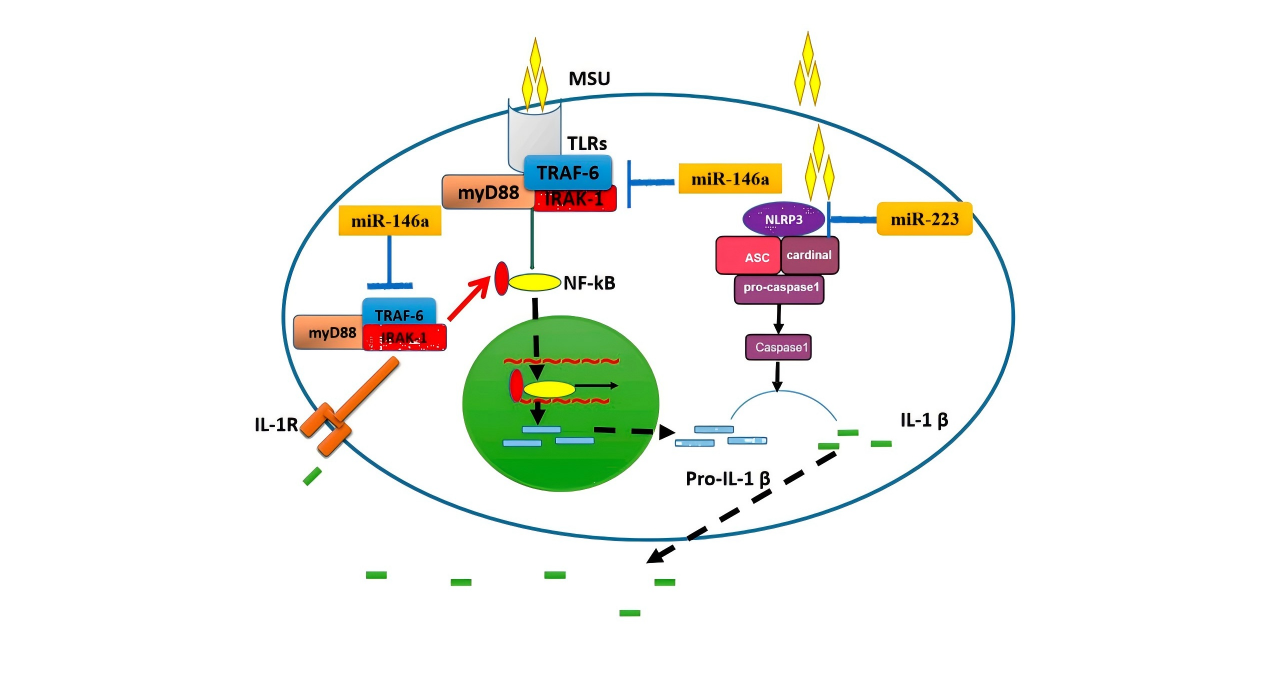
Zhang等以MSU晶体刺激RAW264.7小鼠巨噬细胞建立炎症模型,首次系统阐明了miR-223在痛风炎症中的负向调控作用,揭示其通过靶向NLRP3炎症小体、抑制IL-1β和TNF-α的产生,从而参与痛风急性发作后的自发缓解过程。这为痛风的治疗提供了新的潜在靶点,即通过调控miR-223表达以控制炎症反应[6]。
四、临床意义:从生物标志到双靶干预
IL-1β/TNF-α比值升高提示即将flare,联合检测预测准确率优于单指标(AUC 0.87 vs 0.79)。在治疗策略方面,IL-1路径中Anakinra、Canakinumab已获批,24h内疼痛缓解率可达70%。从TNF-α路径看Etanercept小样本试验显示对难治性痛风有效,且安全性良好。另外通过先IL-1抑制快速止痛→TNF-α抑制减少复发的联合策略,动物实验显示将flare率从70%降至15%(p<0.01)。JAK抑制剂Baricitinib、IL-6R抗体Tocilizumab可同时下调TNF-α与IL-1β转录,用于合并RA/痛风患者一石二鸟。
在人工智能和生物医药技术飞速发展的时代,当 AI 读片 3 秒标出晶体,当纳米抗体把 IL-1β “秒封”,当肠道菌群制剂替你“吃”掉嘌呤——痛风治疗正从“止痛”走向“治愈”。
参考文献
[1] Schett, Georg et al. “Why does the gout attack stop? A roadmap for the immune pathogenesis of gout.” RMD open vol. 1,Suppl 1 e000046. 15 Aug. 2015, doi:10.1136/rmdopen-2015-000046
[2]Dinarello, Charles A. “How interleukin-1β induces gouty arthritis.” Arthritis and rheumatism vol. 62,11 (2010): 3140-4. doi:10.1002/art.27663
[3] Chen, Chen et al. “Monosodium urate crystals with controlled shape and aspect ratio for elucidating the pathological progress of acute gout.” Biomaterials advances vol. 139 (2022): 213005. doi:10.1016/j.bioadv.2022.213005
[4] Sheppe, Austin E F et al. “PGE2 Augments Inflammasome Activation and M1 Polarization in Macrophages Infected With Salmonella Typhimurium and Yersinia enterocolitica.” Frontiers in microbiology vol. 9 2447. 31 Oct. 2018, doi:10.3389/fmicb.2018.02447
[5]Chen, Zilong et al. “A systems immunology perspective on gout pathogenesis and its precision-targeted treatment strategies.” Frontiers in immunology vol. 16 1615914. 19 Jun. 2025, doi:10.3389/fimmu.2025.1615914
[6] Zhang, Quan-Bo et al. “MicroRNA-223 Suppresses IL-1β and TNF-α Production in Gouty Inflammation by Targeting the NLRP3 Inflammasome.” Frontiers in pharmacology vol. 12 637415. 16 Apr. 2021, doi:10.3389/fphar.2021.637415
